Las personas que sobreviven a un accidente cerebrovascular isquémico tienen muchas más probabilidades de desarrollar complicaciones cardíacas importantes durante el primer mes después del ictus y, como resultado, también tienen un mayor riesgo de muerte, ataque cardíaco u otro accidente cerebrovascular dentro de los cinco años, en comparación con las personas que no desarrollan problemas cardíacos poco después de un accidente cerebrovascular, según una nueva investigación publicada en Stroke, la revista insignia revisada por pares de la American Stroke Association, una división de la American Heart Association.
Los autores investigaron la incidencia y los resultados clínicos a largo plazo de las complicaciones cardiovasculares recién diagnosticadas después de un accidente cerebrovascular isquémico.
Para ello, realizaron un estudio de cohorte retrospectivo utilizando registros médicos electrónicos anónimos de 53 organizaciones de atención médica participantes. Se incluyeron pacientes con ictus isquémico incidente de edad ≥ 18 años con 5 años de seguimiento.
Los pacientes que fueron diagnosticados con complicaciones cardiovasculares de nueva aparición (insuficiencia cardíaca, arritmia ventricular grave, fibrilación auricular, cardiopatía isquémica, síndrome de Takotsubo) dentro de las 4 semanas (exposición) del accidente cerebrovascular isquémico incidente tuvieron una puntuación de propensión 1:1 (edad, sexo, etnia, comorbilidades, cuidados cardiovasculares) con pacientes con ictus isquémico que no fueron diagnosticados de una complicación cardiovascular de nueva aparición (control).
Los modelos de regresión logística produjeron razones de probabilidad (OR) con IC del 95 % para la incidencia a 5 años de mortalidad por todas las causas, accidente cerebrovascular recurrente, hospitalización e infarto agudo de miocardio.
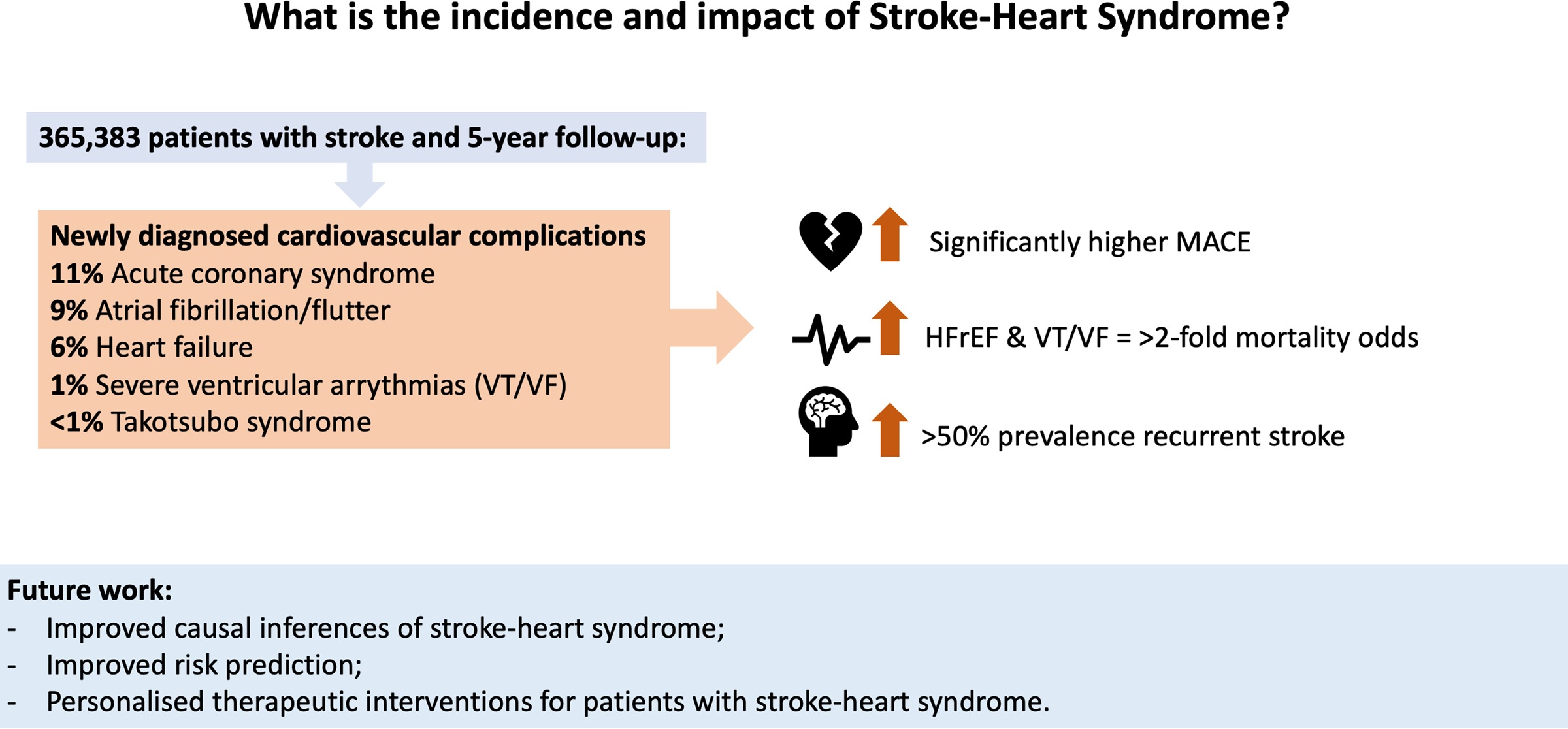
De 365 383 pacientes con accidente cerebrovascular con seguimiento de 5 años: 11,1% desarrolló síndrome coronario agudo; 8,8% fibrilación/aleteo auricular; insuficiencia cardiaca 6,4%; 1,2% arritmias ventriculares graves; y 0,1% síndrome de Takotsubo dentro de las 4 semanas posteriores al accidente cerebrovascular isquémico incidente.
Después de la coincidencia de puntuación de propensión, las probabilidades de mortalidad por todas las causas a los 5 años fueron significativamente mayores en los pacientes con accidente cerebrovascular y síndrome coronario agudo (odds ratio, 1,49 [IC 95 %, 1,44–1,54]), fibrilación/aleteo auricular (1,45 [1,40–1,50 ]), insuficiencia cardíaca (1,83 [1,76–1,91]) y arritmias ventriculares graves (2,08 [1,90–2,29]), en comparación con controles emparejados.
Las probabilidades de rehospitalización a los 5 años e infarto agudo de miocardio también fueron significativamente más altas para los pacientes con accidente cerebrovascular diagnosticados con complicaciones cardiovasculares de nueva aparición.
El síndrome de Takotsubo se asoció con probabilidades significativamente más altas de eventos cardiovasculares adversos mayores compuestos a 5 años (1,89 [1,29–2,77]). La fibrilación/aleteo auricular fue la única complicación cardíaca de nueva aparición asociada con probabilidades significativamente más altas de accidente cerebrovascular isquémico recurrente a los 5 años (1,10 [1,07-1,14]).
Las conclusiones principales fueron:
- Las complicaciones cardiovasculares de nueva aparición diagnosticadas tras un ictus isquémico son muy frecuentes y se asocian a un pronóstico a 5 años significativamente peor en términos de eventos cardiovasculares adversos mayores.
- Las personas con accidente cerebrovascular y complicaciones cardiovasculares recién diagnosticadas tenían una prevalencia >50 % de accidente cerebrovascular recurrente a los 5 años.
Vea el artículo completo en:
Buckley, B. J., Harrison, S. L., Hill, A., Underhill, P., Lane, D. A., & Lip, G. Y. (2022). Stroke-Heart Syndrome: Incidence and Clinical Outcomes of Cardiac Complications Following Stroke. Stroke, STROKEAHA-121.