 La teixobactina es un péptido undecadapsipéptido cíclico que ha demostrado una excelente potencia contra patógenos resistentes a múltiples fármacos, como el Staphylococcus aureus resistente a la meticilina (MRSA) y los enterococos resistentes a la vancomicina (VRE).
La teixobactina es un péptido undecadapsipéptido cíclico que ha demostrado una excelente potencia contra patógenos resistentes a múltiples fármacos, como el Staphylococcus aureus resistente a la meticilina (MRSA) y los enterococos resistentes a la vancomicina (VRE).
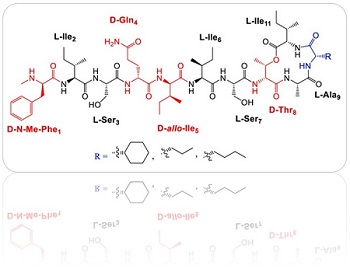
La red Intramed propone un artículo publicado en European Journal of Medicinal Chemistry donde se presentan el diseño, la síntesis y las evaluaciones antibacterianas de 16 análogos diferentes de teixobactina. Estos análogos simplificados contienen residuos de aminoácidos no proteógenos hidrófobos disponibles comercialmente, en lugar de residuos de aminoácidos de L-alo-enduracididina costosos y sintéticamente desafiantes en la posición 10 junto con diferentes combinaciones de argininas en las posiciones 3, 4 y 9.
Los nuevos análogos de teixobactina mostraron potente actividad antibacteriana contra un amplio panel de bacterias Gram positivas, incluidas cepas MRSA y VRE. Este trabajo también presenta la primera demostración de la potente actividad antibiopelícula de los análogos de teixobactina contra especies de Staphylococcus asociadas con infecciones crónicas graves.
Casi cinco millones de personas pierden la vida debido a infecciones asociadas a la resistencia a los antibióticos y millones más viven con mala calidad de vida debido a fallos en el tratamiento. La resistencia a los antimicrobianos (RAM) está aumentando y una revisión de la RAM encargada por el gobierno del Reino Unido ha predicho que para 2050 otros 10 millones de personas sucumbirán cada año a infecciones resistentes a los medicamentos. El desarrollo de nuevos antibióticos que puedan utilizarse como último recurso cuando otros fármacos son ineficaces es un área de estudio crucial para los investigadores sanitarios de todo el mundo.
Este trabajo se basa en una investigación pionera realizada por el Dr. Ishwar Singh de la Universidad de Liverpool, experto en descubrimiento y desarrollo de fármacos antimicrobianos y química medicinal. Un equipo de investigadores dirigido por el Dr. Singh desarrolló versiones sintéticas simplificadas de la molécula natural teixobactina, que las bacterias productoras utilizan para matar otras bacterias en el suelo.
En este proceso se optimizaron características clave del fármaco para mejorar su eficacia y seguridad, además de permitir su producción económica a gran escala. Durante la síntesis del compuesto, cambiaron el bloque de construcción clave L-alo-enduracididina por bloques de construcción simplificados de bajo costo disponibles comercialmente, como los aminoácidos no proteogénicos.
Vea el texto completo en: Potente actividad de un antibiótico sintético contra «superbacterias». Intramed. Noticias – 5 enero 2024 (dbe registrarse en el sitio web).
 Este editorial publicado en la
Este editorial publicado en la 


